Nature:减肥为何减不了腹部脂肪?这类免疫细胞有话说
“这项研究的关键发现在于发现免疫细胞与神经系统相互交流,调控制新陈代谢。”
在一项最新研究中,耶鲁大学的研究人员发现了神经系统和免疫系统如何相互沟通,调控代谢与炎症的分子机制,这一发现将有助于解释为何老年人无法燃烧存储的腹部脂肪,这些脂肪会给他们的健康带来慢性疾病的威胁。同时研究人员也指出,这项研究也提出了针对这一问题的潜在治疗方法。
这一研究成果公布在9月27日的Nature杂志上,由耶鲁大学比较医学和免疫生物学教授Vishwa Deep Dixit领导完成。

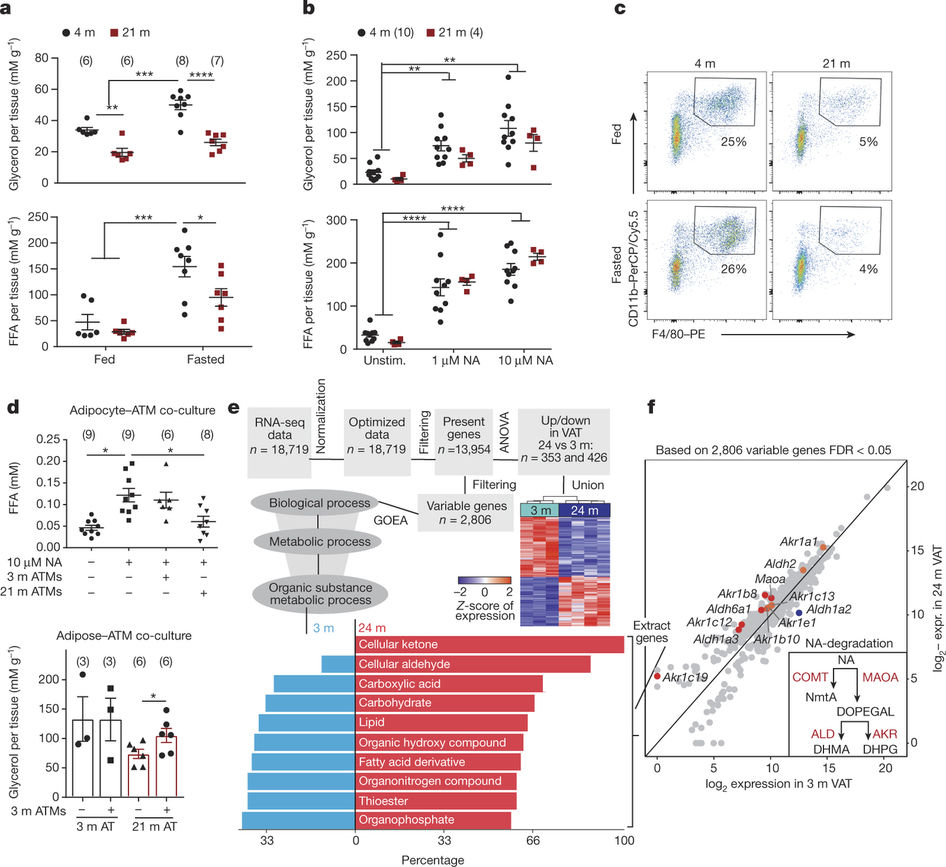
腹部脂肪主要为内脏脂肪,当人体摄入热量大于消耗的热量时,多余的热量会转化为脂肪,暂存在腹部,等热量不足时可快速燃烧提供能量。如果一个人长期摄入热量过多,腹部脂肪只存不取,就容易引起腹型肥胖(中心性肥胖)。而对于老年人来说,无论其体重是多少,都会增加腹部脂肪。因为当他们需要消耗能量时,老年人不会像年轻的成年人一样有效地燃烧储存在脂肪细胞中的能量,这就会导致有害腹部脂肪的积累。这其中的根本原因,迄今依然是一个谜题。
在这项研究中,Dixit与田纳西大学卫生科学中心等处的研究人员合作,针对一类特殊的免疫细胞:巨噬细胞展开了研究,这类细胞通常参与控制感染。Dixit实验室发现了一种新型的巨噬细胞,位于腹部脂肪的神经上,能随年龄增长而出现炎症,令作为化学信使的神经递质无法正常发挥功能。
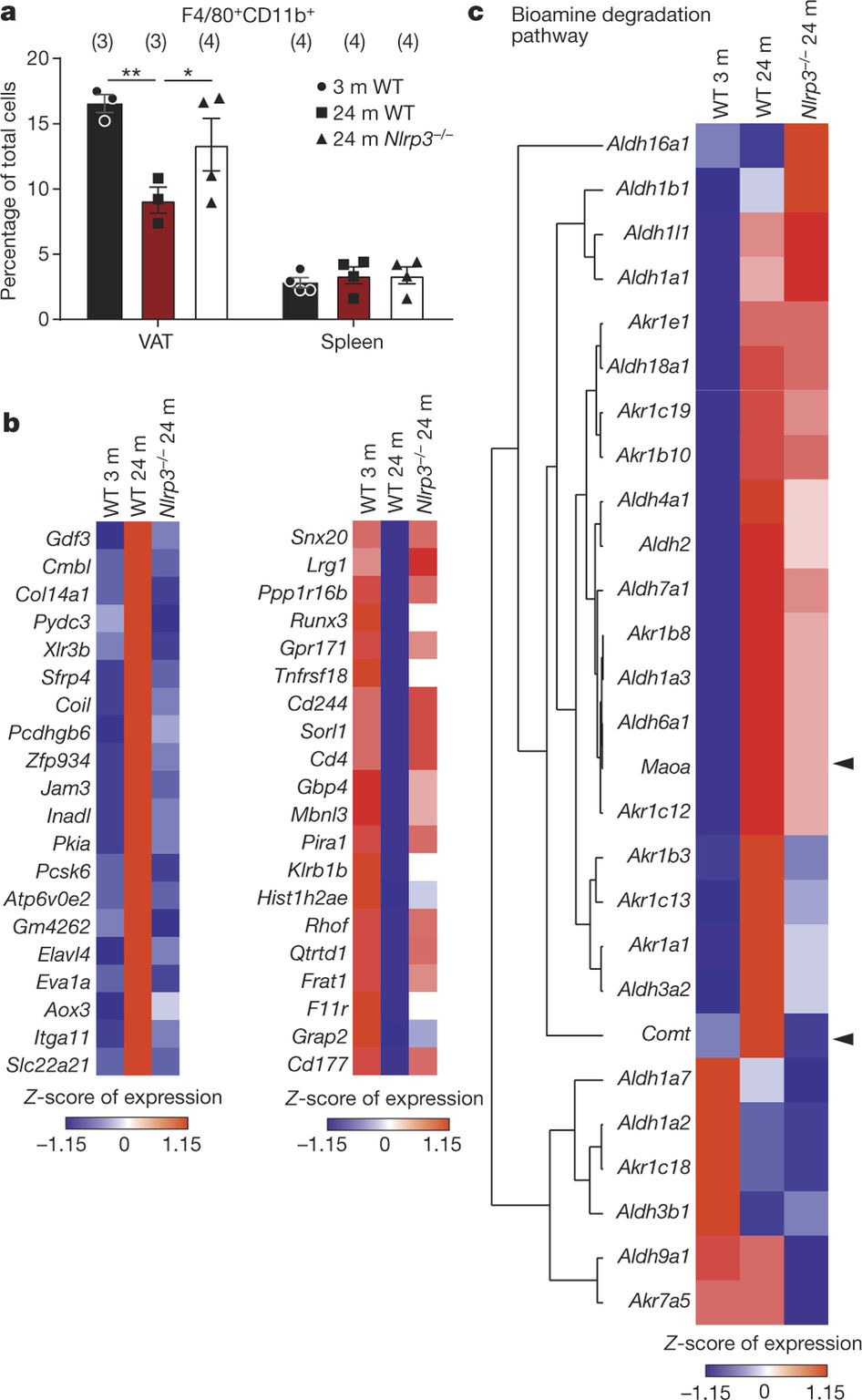
研究人员还从年轻和年老小鼠的脂肪组织中分离出了免疫细胞,然后对基因组进行测序。
“我们发现,老化的巨噬细胞可以分解称为儿茶酚胺的神经递质,因此在需求出现时,脂肪细胞无法供应燃料,”Dixit说。
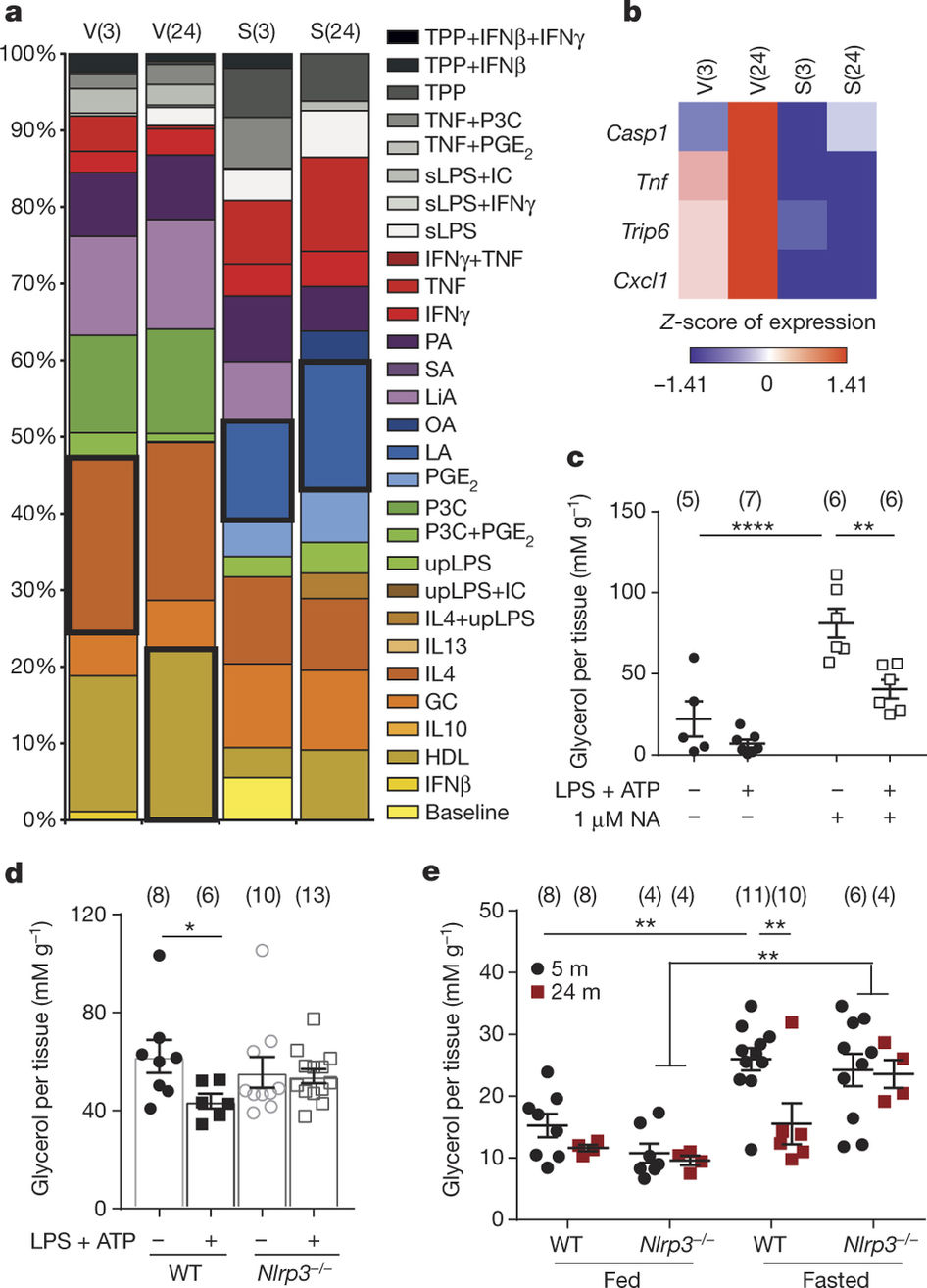
研究人员也发现,当他们减少了控制炎症的一种特异性受体:NLRP3炎症小体时,老年巨噬细胞中的儿茶酚胺就能起到诱导脂肪分解的作用,就像是年轻小鼠的巨噬细胞一样。
Dixit说:“这项研究的关键发现在于发现免疫细胞与神经系统相互交流,调控制新陈代谢。”
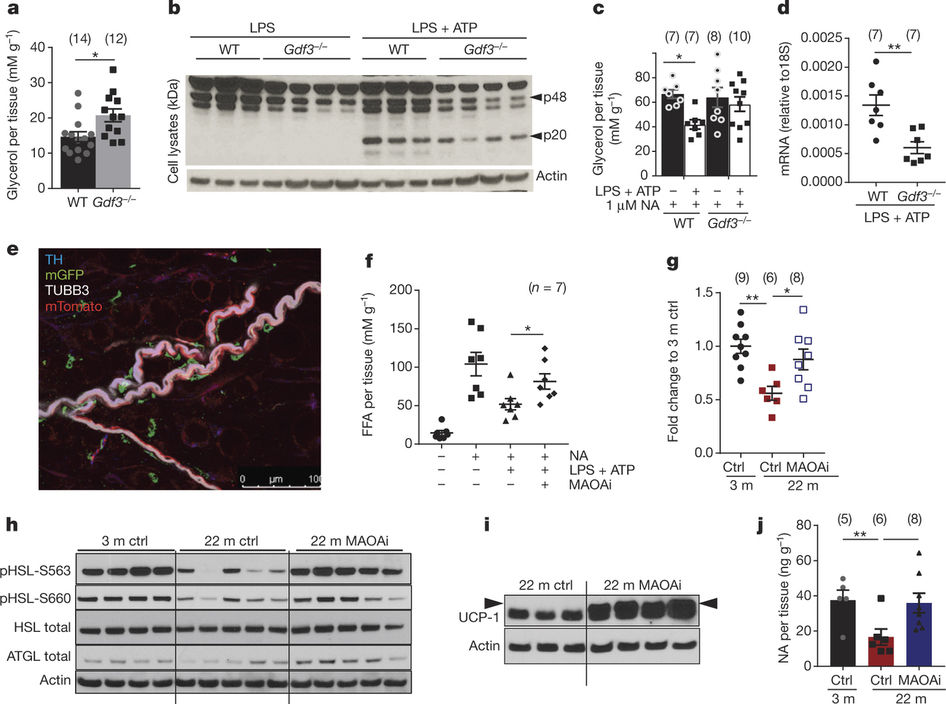
之后,通过进一步的实验,研究人员阻断了一种在老年巨噬细胞中会增加的酶,结果恢复了老年小鼠的正常脂肪代谢。 Dixit指出,这种酶:单胺氧化酶-A(MAOA)在治疗抑郁症中能通过现有药物被抑制。“理论上,可以重新设计这些MAOA抑制剂药物,改善老年人的新陈代谢。”但他也警告说,还需要进行更多的研究,检测这些药物对腹部脂肪的作用,以及这种方法的安全性。
在未来的研究中,Dixit及其同事将进一步研究免疫细胞及其与神经的相互作用,以及这种神经免疫交流如何控制健康和疾病。研究人员表示,如果调控衰老免疫细胞的炎症可以改善新陈代谢,那么它可能对神经系统或衰老过程本身具有其它积极作用。
文章的第一作者Christina D. Camell说:“我们研究的目的是为了更好地了解免疫细胞与神经,以及脂肪组织之间的相互作用,从而能腹部脂肪,增强新陈代谢,改善老年人的生活质量。”
Inflammasome-driven catecholamine catabolism in macrophages blunts lipolysis during ageing
Christina D. Camell, Jil Sander, Olga Spadaro, Aileen Lee, Kim Y. Nguyen, Allison Wing, Emily L. Goldberg, Yun-Hee Youm, Chester W. Brown, John Elsworth, Matthew S. Rodeheffer, Joachim L. Schultze & Vishwa Deep Dixit
Catecholamine-induced lipolysis, the first step in the generation of energy substrates by the hydrolysis of triglycerides1, declines with age2, 3. The defect in the mobilization of free fatty acids in the elderly is accompanied by increased visceral adiposity, lower exercise capacity, failure to maintain core body temperature during cold stress, and reduced ability to survive starvation. Although catecholamine signalling in adipocytes is normal in the elderly, how lipolysis is impaired in ageing remains unknown2, 4. Here we show that adipose tissue macrophages regulate the age-related reduction in adipocyte lipolysis in mice by lowering the bioavailability of noradrenaline. Unexpectedly, unbiased whole-transcriptome analyses of adipose macrophages revealed that ageing upregulates genes that control catecholamine degradation in an NLRP3 inflammasome-dependent manner. Deletion of NLRP3 in ageing restored catecholamine-induced lipolysis by downregulating growth differentiation factor-3 (GDF3) and monoamine oxidase A (MAOA) that is known to degrade noradrenaline. Consistent with this, deletion of GDF3 in inflammasome-activated macrophages improved lipolysis by decreasing levels of MAOA and caspase-1. Furthermore, inhibition of MAOA reversed the age-related reduction in noradrenaline concentration in adipose tissue, and restored lipolysis with increased levels of the key lipolytic enzymes adipose triglyceride lipase (ATGL) and hormone sensitive lipase (HSL). Our study reveals that targeting neuro-immunometabolic signalling between the sympathetic nervous system and macrophages may offer new approaches to mitigate chronic inflammation-induced metabolic impairment and functional decline.
部分From: 生物通


