常用一线化疗药紫杉醇促进癌症转移背后的机制
自上个世纪下叶被发现以来,紫杉醇(Paclitaxel,PTX)就一直是化疗界的明星。因为其高度抗癌活性,紫杉醇目前已经被广泛应用于卵巢癌、乳腺癌、肺癌等多种癌症的一线治疗[1]。曾经有过新闻,紫杉醇的原料红豆杉被百姓剥了树皮泡酒,引为抗癌“神药”(当然了,这是个错误的做法,直接服用红豆杉可是会中毒的)。
不过,紫杉醇的作用也是把双刃剑,在利用细胞毒性杀死癌细胞的同时,它也会增加癌细胞对化疗剂的抗性并促进癌细胞转移。在8月份的《美国国家科学院院刊》(PNAS)上,来自俄亥俄州立大学生物化学与药理学教授Tsonwin Hai团队的一项研究为紫杉醇促进乳腺癌的肺转移[2]提供了“实锤”。

Tsonwin Hai教授
研究结果揭示了两个主要的机制:一是紫杉醇会改变原发肿瘤周边血管的状态,帮助乳腺癌细胞进入血循环;二是它还会在肺组织中“辛勤耕耘”,使肺组织微环境更适合癌细胞生存,促进癌细胞“生根发芽”。而这些有害影响,都要通过一个名为Atf3的基因来实现。
Atf3是一种应激快反应基因,正常情况下表达量非常低,当受到外界信号刺激,就会快速大量表达。表达产物Atf3蛋白是一种转录因子,能够直接或间接调控很多参与炎症反应的基因的表达[3]。
那么究竟科学家是怎么证实紫杉醇的“叛变”行为的呢?
Hai教授和她的团队在小鼠身上进行了试验。他们对能够发生自发转移的乳腺癌模型小鼠注射了一定量的紫杉醇。比起对照组,注射了紫杉醇的实验组小鼠原发肿瘤确实有缩小,但是转移到肺部的癌细胞却更多!研究者对敲除了Atf3基因的小鼠也做了同样的实验,结果却并没有什么差别。这足以说明紫杉醇的这种促进癌症转移的作用与Atf3基因有关了。
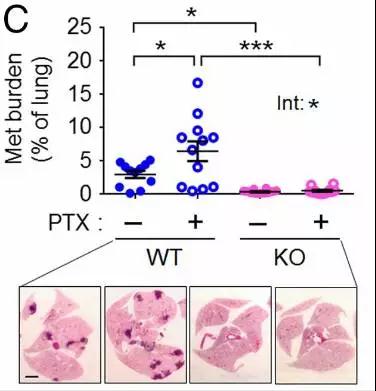
上:在第26天,不使用紫杉醇治疗和使用紫杉醇治疗以及敲除Atf3基因后不使用紫杉醇治疗和使用紫杉醇治疗的
四种小鼠肺转移肿瘤占总肺部的面积
下:四种小鼠的肺部切片,深色部分为转移瘤
为了搞清除紫杉醇和Atf3基因到底是怎么使坏的,研究人员对这几种肿瘤组织进行了检测,发现用紫杉醇治疗的小鼠肿瘤组织中微血管的密度特别高,而且一些能帮助肿瘤转移和新血管生成的细胞(表达Tie2基因的单核巨噬细胞,TEMs)也增加了。他们还发现,和血管生成有关的一些基因表达量高(如Ang1,Notch1和Cxcl1),和抗血管生成有关的一些基因表达量低(如Cxcl9、10、11和14)。
另外,还有一个有意思的现象,乳腺癌细胞扩散需要通过三种细胞的直接接触——内皮细胞、血管周围巨噬细胞和增强癌细胞扩散能力的Mena蛋白水平高的癌细胞。过去的研究发现,这三种细胞在哪里接触,癌细胞就在哪里进入血管,后来,这个“位点”被命名为肿瘤转移微环境(tumor microenvironment of metastasis,TMEM)[4]。
所以,TMEM就相当于一扇门,当“三把钥匙”聚齐时,癌细胞就可以打开门,进入血管中了。在这次的研究中,研究人员也发现,使用紫杉醇治疗的小鼠TMEM密度明显升高,这也说明,紫杉醇为癌细胞多造了几扇门,帮助了它向肺部转移。这和不久前发表在《科学转化医学》上的另一项研究“不谋而合”,他们在化疗的癌症患者身上也发现了这个现象[5]。
所以这几项指标的变化意味着,紫杉醇不光给癌细胞开拓了更多的“出走路线(微血管)”,还帮它们打开了脱离桎梏的“大门(TMEM)”。
以上这些结果都只出现在野生型小鼠上,敲除了Atf3基因的小鼠实验组和对照组没有明显差异。这说明,紫杉醇的使用促进血管生长、增加癌细胞转移微环境,这些影响都是通过Atf3基因实现的。
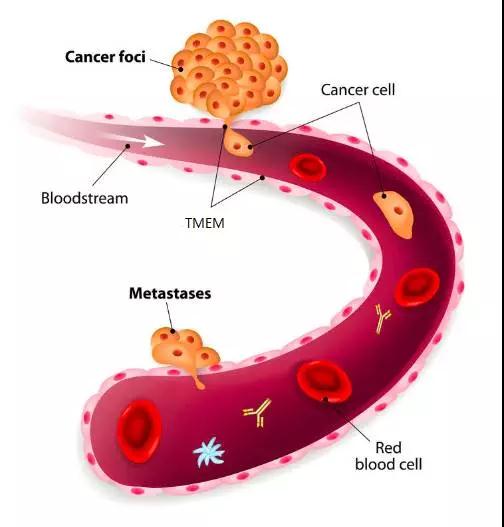
癌细胞通过TMEM进入血管
只关注原发肿瘤还不够,研究人员又盯上了癌细胞转移的目标组织——肺部。他们给用紫杉醇预处理过的小鼠静脉注射癌细胞,最大程度地消除了紫杉醇对癌细胞的直接杀伤影响。
结果显示,注射过紫杉醇的实验组肺组织比对照组有更多的癌细胞定殖。对肺组织的检测发现,实验组中穿孔素(Prf1)表达下调,炎症性单核细胞(iMs)数量上升,趋化因子配体2(CCL2)表达上调。
Prf1是重要的溶菌蛋白之一,存在于细胞毒性T细胞和天然杀伤(NK)细胞中,有抑癌作用[6];iMs可以进入肺中分化成巨噬细胞,促进肿瘤转移[7];而CCL2是一种小分子蛋白,可以促进炎症性单核细胞富集,增强炎症反应,对肿瘤发展起着重要作用[8]。
同样,这些结果也只出现在野生型小鼠上。这说明,紫杉醇的使用改变了肺组织的微环境,使癌细胞更容易在肺组织上定殖,这些影响也是通过Atf3基因实现的。
那么现在我们可以确定了,紫杉醇一方面促使肿瘤细胞从原发肿瘤逃离,一方面改变肺部微环境使之更适合肿瘤细胞定殖,而Atf3基因在其中起关键作用。
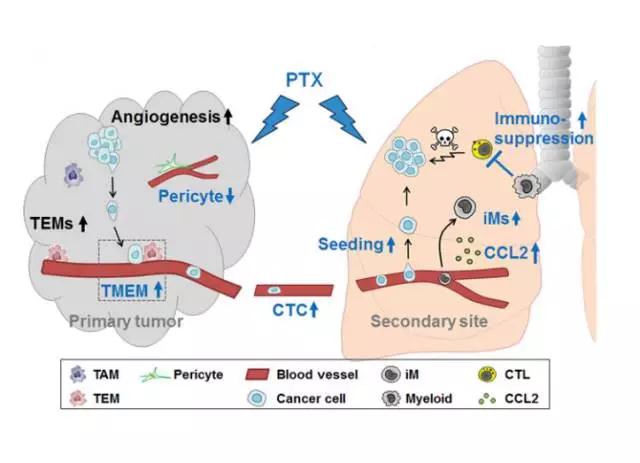
紫杉醇(PTX)对原发肿瘤和转移组织的影响
要不是看到这些证据,奇点糕真是不愿意相信,紫杉醇竟然助纣为虐!不过,这些在小鼠身上得到的实验结果,是否适用于人类呢?
研究者们自然也考虑到了这一点。为了证实小鼠数据与人类癌症的相关性,他们从公开的肿瘤数据库[9]中的样本数据进行了分析。结果不出所料,在接受了化疗的乳腺癌患者的肿瘤组织中,Atf3真的有更高的表达。相应的,患者也出现了高水平的CCL2、CCL7、CCL8等炎症指标以及低水平的Prf1、NK细胞和细胞毒性T细胞等。
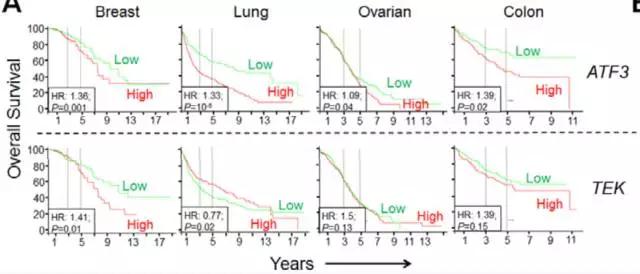
在乳腺癌、肺癌、卵巢癌和结肠癌中,ATF3基因和TEK基因高表达(红)和低表达(绿)对患者生存率的影响
这些分析结果与小鼠试验的表征是一致的,可见小鼠试验结果的确能揭示紫杉醇在人体癌症转移中起到的作用。
研究人员还使用其他株系的癌细胞替换了他们在这次实验中所用的乳腺癌细胞,还尝试用其他化疗药物如环磷酰胺(CTX)替换紫杉醇,甚至还使用不同种系的小鼠进行了实验,结果无一例外。Atf3基因介导的化疗剂对癌症肺转移的促进作用不局限于单一化疗药物、单个癌种或单个试验对象,这是一种在化疗中普遍存在的现象。
鉴于早先有研究表明,全身化疗后残留的肿瘤与临床上的不良预后有关[10],那么,这个研究可以说是对今后化疗的使用很有临床意义了。Hai教授表示,或许将来可以通过抑制Atf3基因的表达来解除化疗的这个副作用,这也是他们的下一个研究目标。
不过这个研究也存在一些局限性:对小鼠的整体研究没有办法确定在不同类型细胞中Atf3基因的作用;而且除了血管转移途径之外,癌细胞也可以通过淋巴管转移,Atf3基因对这条路线的影响还未可知等等。
“研究者应当随时保持一个开阔的眼界。”Hai教授在一次采访中如是说[11]。奇点糕想,科学或许就是在对前人的颠覆上不断前行、不断进步的吧。
参考资料:
[1] "Paclitaxel". The American Society of Health-System Pharmacists. Retrieved January 2, 2015.
[2] Yi Seok Chang, Swati P. Jalgaonkar, Justin D. Middleton, Tsonwin Hai.Proceedings of the National Academy of Sciences, 2017; 201700455 DOI: 10.1073/pnas.1700455114.
[3] Corradini P, Ladetto M, Pileri A, Tarella C (1999) Clinical relevance of minimal residual disease monitoring in non-Hodgkin’s lymphomas: A critical reappraisal of molecular strategies. Leukemia 13:1691–1695.
[4] Harney AS, et al. (2015) Real-time imaging reveals local, transient vascular permeability, and tumor cell intravasation stimulated by TIE2hi macrophage-derived VEGFA. Cancer Discov 5:932–943.
[5] George S. Karagiannis, Jessica M. Pastoriza, Yarong Wang et al. Neoadjuvant chemotherapy induces breast cancer metastasis through a TMEM-mediated mechanism. Science Translational Medicine, 05 Jul 2017, 9(397):eaan0026, doi:10.1126/scitranslmed.aan0026.
[6] Barry M, Bleackley RC (2002) Cytotoxic T lymphocytes: All roads lead to death. Nat Rev Immunol 2:401–409.
[7] Qian BZ, et al. (2011) CCL2 recruits inflammatory monocytes to facilitate breasttumour metastasis. Nature 475:222–225.
[8] Qian B, et al. (2009) A distinct macrophage population mediates metastatic breast
cancer cell extravasation, establishment and growth. PLoS One 4:e6562.
[9] Boersma BJ, et al. (2008) A stromal gene signature associated with inflammatory breast cancer. Int J Cancer 122:1324–1332.
[10] Symmans WF, et al. (2017) Long-term prognostic risk after neoadjuvant chemotherapy associated with residual cancer burden and breast cancer subtype. J Clin Oncol 35: 1049–1060.
[11] https://www.sciencedaily.com/releases/2017/08/170807155401.html
From 奇点网


